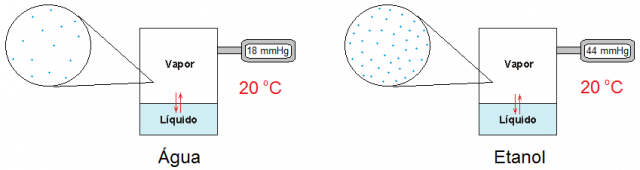
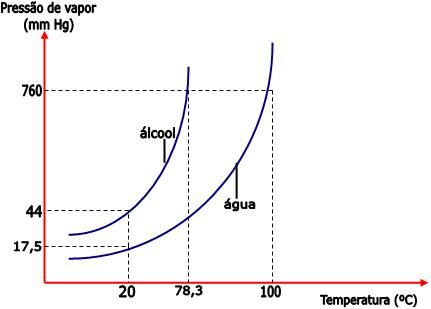
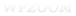Por que o etanol evapora mais rapidamente que a água? A pressão de vapor.
Este efeito está relacionado com a pressão máxima de vapor ou simplesmente Pressão de Vapor (Pv) do líquido. A pressão de vapor é a pressão máxima exercida pelo vapor em contato com o próprio líquido, quando se atinge o equilíbrio dinâmico entre a fase líquida e a gasosa, isto é, neste caso, a velocidade de evaporação é igual à velocidade de condensação. Portanto, um líquido que evapora com mais facilidade, numa dada temperatura, possui uma pressão de vapor maior.
A Pv depende do líquido em questão e da temperatura. Por exemplo, o etanol evapora mais facilmente que a água e é por isso que apresenta Pv maior (Pv etanol a 20 oC = 44 mmHg; Pv água a 20 oC = 18 mmHg); podemos dizer que quanto mais rapidamente um líquido evaporar, maior sua Pv. A Pv também depende da temperatura; quanto maior a temperatura maior a quantidade de vapor em equilíbrio com seu próprio líquido, isto é, maior a pressão de vapor.
À medida que um líquido vai sendo aquecido, sua pressão de vapor vai aumentando; no momento em que a pressão de vapor se iguala a pressão externa (normalmente a pressão atmosférica), o líquido entra em ebulição. Ao nível do mar a pressão atmosférica é igual a 760 mmHg (1 atm), portanto, quando a pressão de vapor de um líquido atinge 760 mmHg (ao nível do mar), o mesmo entra em ebulição. Para a água, a Pv atinge 760 mmHg em 100 oC, e é por isso que a temperatura de ebulição da água ocorre nesta temperatura. No caso do etanol, a Pv atinge 760 mmHg em 78,3 oC, e é por isso que a temperatura de ebulição do etanol ocorre nesta temperatura.
À medida que a altitude aumenta a pressão atmosférica diminui; logo, a temperatura de ebulição das substâncias vai ficando cada vez mais baixas já que a pressão de vapor para igualar a pressão externa também vai diminuindo (considerando um sistema aberto).
Depende do líquido
Depende da temperatura